[1º] ¿Qué es la hemoglobina?
La hemoglobina es una heteroproteína de la sangre, de masa molecular 64.000 g/mol (64 kDa), de color
rojo
característico, que transporta el oxígeno desde los órganos respiratorios hasta los
tejidos, el dióxido de carbono desde los tejidos hasta los pulmones que lo
eliminan y también participa en la regulación de pH de la sangre, en vertebrados y algunos invertebrados.
La hemoglobina es una proteína de estructura cuaternaria, que consta de
tres subunidades. Su función principal es el transporte de oxígeno. Esta
proteína hace parte de la familia de las hemoproteínas, ya que posee un grupo
hemo.
[2º] Estructura Molecular
La forman cuatro cadenas polipeptídicas (globinas) a cada una de las cuales se une un
grupo hemo, cuyo átomo de hierro es capaz de unir de forma reversible una molécula de oxígeno. El grupo hemo está formado por:
- Unión del succinil-CoA (formado en ciclo de Krebs o ciclo del ácido cítrico) al aminoácido glicina formando un grupo pirrol.
- Cuatro grupos pirrol se unen formando la protoporfirina IX.
- La protoporfirina IX se une a un ion ferroso (Fe2+) formando el grupo hemo
La hemoglobina es una proteína tetrámera, que consiste de cuatro cadenas
polipeptídicas con estructuras primarias diferentes. La hemoglobina presente en
los adultos (HbA) tiene dos cadenas α y dos cadenas β. La cadena α consiste de
141 aminoácidos y una secuencia específica, mientras que la cadena β consiste
de 146 aminoácidos con una estructura primaria diferente. Estas cadenas son
codificadas por genes diferentes y tienen estructuras primarias diferentes. En
el caso de las cadenas δ y γ de otros tipos de hemoglobina humana, como la
hemoglobina fetal (HbF) es muy similar a la cadena β. La estructura tetrámera de
los tipos comunes de hemoglobina humana son las siguientes: HbA1 tiene α2β2,
HbF tiene α2γ2 y HbA2 (tipo menos común en los adultos) tiene α2δ2. Las cadenas
α y β de la hemoglobina tienen un 75% de hélices alfa como estructura
secundaria, con 7 y 8 segmentos respectivamente. Cada cadena polipeptídica de
la hemoglobina está unida a un grupo hemo para formar una subunidad. Las cuatro
subunidades de la hemoglobina en su estructura cuaternaria forman un tetraedro.
Y sus subunidades se unen entre ellas por puentes de sal, que estabilizan su
estructura.
El grupo hemo está localizado en un hoyuelo entre dos hélices de la
cadena de la globina y a su vez está protegido por un residuo de valina. Los
grupos vinilo no polares del grupo hemo se encuentran en el interior
hidrofóbico del hoyuelo, mientras que los grupos profirina polares cargados se
encuentran orientados hacia la superficie hidrofílica de la subunidad. También
se encuentran residuos de histidina de las cadenas polipeptídicas, que se
enlazan al átomo de hierro y se designan como histidinas proximales, ya que
están presentes cerca al grupo hemo. Mientras que la histidina distal se
encuentra lejos del grupo hemo. El átomo de hierro se encuentra en el centro
del anillo de profirina y tiene seis valencias. El hierro está unido al
nitrógeno de los cuatro anillos de pirol por cuatro de sus valencias, su quinta
valencia se une al nitrógeno de la histidina proximal y la sexta está ocupada
por la hisitidina distal o por oxígeno.
Se puede estudiar las propiedades del enlace entre el oxígeno y la
hemoglobina a partir de la curva de enlace de oxígeno, la cual presenta la
saturación fraccional, respecto a la concentración del mismo. La saturación
fraccional, Y, se define como el número de sitios de enlace saturados con oxígeno
respecto al número total de sitios de enlace posibles en una molécula de
hemoglobina. El valor de Y puede ir desde 0 (todos los sitios de enlace están
sin oxígeno) hasta 1 (todos los sitios de enlace están enlazados con oxígeno).
La concentración de oxígeno se mide en presión parcial, pO2. La curva de enlace
de la hemoglobina es sigmoidea. Esta forma de la curva sugiere que el enlace de
oxígeno a un sitio de enlace, aumenta la probabilidad de que se enlace otro
oxígeno a un sitio de enlace vacío. Así mismo la liberación de oxígeno de un
sitio de enlace facilita la liberación de oxígeno de otros sitios de enlace. A
este comportamiento se le llama cooperativo, porque las reacciones de enlace en
sitios de enlace individuales en cada molécula de hemoglobina están
relacionadas e influyen directamente en las reacciones de enlace de los otros
sitios de enlace de cada molécula.
El comportamiento cooperativo de la hemoglobina es indispensable para un
transporte eficiente del oxígeno dentro del cuerpo. En los pulmones, la
hemoglobina se satura en un 98% de oxígeno. Esto quiere decir que un 98% de los
sitios de enlace de cada molécula de hemoglobina están enlazados a una molécula
de oxígeno. Al movilizarse la hemoglobina por la sangre, libera el oxígeno a
las células, y su nivel de saturación se reduce a un 32%. Esto quiere decir que
un 66% (98% - 32% = 66%) de los sitios de enlace de la hemoglobina contribuyen
al transporte y descarga de oxígeno. Si una proteína, que no presenta un
comportamiento de enlace cooperativo realiza el mismo trabajo que la
hemoglobina su eficiencia se verá reducida notablemente, por ejemplo la
mioglobina tiene una eficiencia del 7%.
La presión a la cual la hemoglobina se encuentra saturada en un 50%
(p50) muestra la afinidad de distintos tipos de hemoglobina respecto al
oxígeno. En la HbA (Hemoglobina adulta), p50 es a 26 mmHg, mientras que la HbF
tiene un p50 a 20 mmHg. Esta diferencia en la afinidad relativa por O2 permite
a la HbF extraer oxígeno de la HbA de la sangre placentaria de la madre para
que el feto la utilice. Después del nacimiento, la HbF es reemplazada por la
HbA. El comportamiento de enlace cooperativo de la hemoglobina con el O2
requiere que el enlace de oxígeno en un sitio de enlace en el tetrámero de la
hemoglobina influya en los otros sitios de enlace dentro de la misma molécula.
Estos cambios se evidencian en su estructura cuaternaria. Los dímeros α1β1 y
α2β2 rotan aproximadamente 15 grados el uno respecto al otro. La estructura
cuaternaria observada en el estado deoxi de la hemoglobina se conoce como el
estado T (Tenso), ya que las interacciones entre sus subunidades son fuertes.
Mientras que la estructura de la hemoglobina completamente oxigenada,
oxihemoglobina, es conocida como el estado R (Relajado), ya que las interacciones
entre sus subunidades se encuentran debilitadas (o relajadas). Al desencadenar
el paso del estado T al estado R, el enlace de un oxígeno aumenta la afinidad
de otros sitios de enlace.
Se puede explicar la cooperatividad de la hemoglobina a partir de
distintos modelos. Se han desarrollado 2 modelos diferentes. El modelo
concertado (Modelo MWC) explica que la hemoglobina tiene únicamente 2 formas:
el estado T y el estado R. Al enlazarse con un ligando, el equilibrio cambia
entre estos 2 estados. La deoxihemoglobina se considera en estado T. Pero al
enlazarse un oxígeno, el estado R está muy favorecido. En este estado se
favorece fuertemente el enlace de más oxígenos. En este modelo, cada tetrámero
puede existir exclusivamente en dos estados (T o R). En cambio el modelo
secuencial explica que la unión de un oxígeno a la hemoglobina favorece la
unión de más oxígenos, pero no significa un cambio total del estado T al esta
[3º] Oxihemoglobina
Cuando la hemoglobina tiene unido oxígeno se denomina oxihemoglobina o hemoglobina oxigenada, dando el aspecto rojo o escarlata intenso característico de la sangre arterial. Cuando pierde el oxígeno, se denomina hemoglobina reducida, y presenta el color rojo oscuro de la sangre venosa (se manifiesta clínicamente por cianosis).
- Reacción paso a paso:
- Reacción total:
[4º] Tipos de hemoglobina
- Hemoglobina A o HbA, llamada también hemoglobina del adulto o hemoglobina normal, representa aproximadamente el 97% de la hemoglobina en el adulto. Está formada por dos globinas alfa y dos globinas beta.
- Hemoglobina A2: Representa menos del 2,5% de la hemoglobina después del nacimiento. Está formada por dos globinas alfa y dos globinas delta. Sufre un aumento marcado en la beta-talasemia, al no poderse sintetizar globinas beta.
- Hemoglobina S: Hemoglobina alterada genéticamente presente en la anemia de células falciformes. Afecta predominantemente a la población afroamericana y amerindia.
- Hemoglobina F: Hemoglobina fetal: formada por dos globinas alfa y dos globinas gamma. Tras el nacimiento desciende la síntesis de globinas gamma y aumenta la producción de globinas beta.
- Oxihemoglobina: Representa la hemoglobina que posee unido oxígeno (Hb+O2)
- Metahemoglobina: Hemoglobina cuyo grupo hemo tiene el hierro en estado férrico, Fe (III) (es decir, oxidado). Este tipo de hemoglobina no puede unir oxígeno. Se produce por una enfermedad congénita en la cual hay deficiencia de metahemoglobina reductasa, enzima encargada de mantener el hierro como Fe(II). La metahemoglobina también se puede producir por intoxicación de nitritos.
- Carbaminohemoglobina: se refiere a la hemoglobina que ha unido CO2 después del intercambio gaseoso entre los glóbulos rojos y los tejidos (Hb+CO2).
- Carboxihemoglobina: Hemoglobina resultante de la unión con el CO. Es letal en grandes concentraciones (40%). El CO presenta una afinidad 200 veces mayor que el oxígeno por la Hb, por lo que desplaza a este fácilmente y produce hipoxia tisular, pero con una coloración cutánea normal (produce coloración sanguínea fuertemente roja) (Hb+CO).
- Hemoglobina glucosilada: aunque se encuentra normalmente presente en sangre en baja cantidad, en patologías como la diabetes se ve aumentada. Es el resultado de la unión de la Hb con glucosa u otros carbohidratos libres.
También hay hemoglobinas de los tipos: Gower 1, Gower 2 y Portland. Éstas sólo están presentes en el embrión.
Citar: http:www.google.com/lahemoglobina





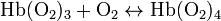
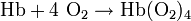
No hay comentarios:
Publicar un comentario